硫酸的制备的正确操作(硫酸制备要点谈)
发布于:2024-10-08 09:23:17

发布于:2024-10-08 09:23:17
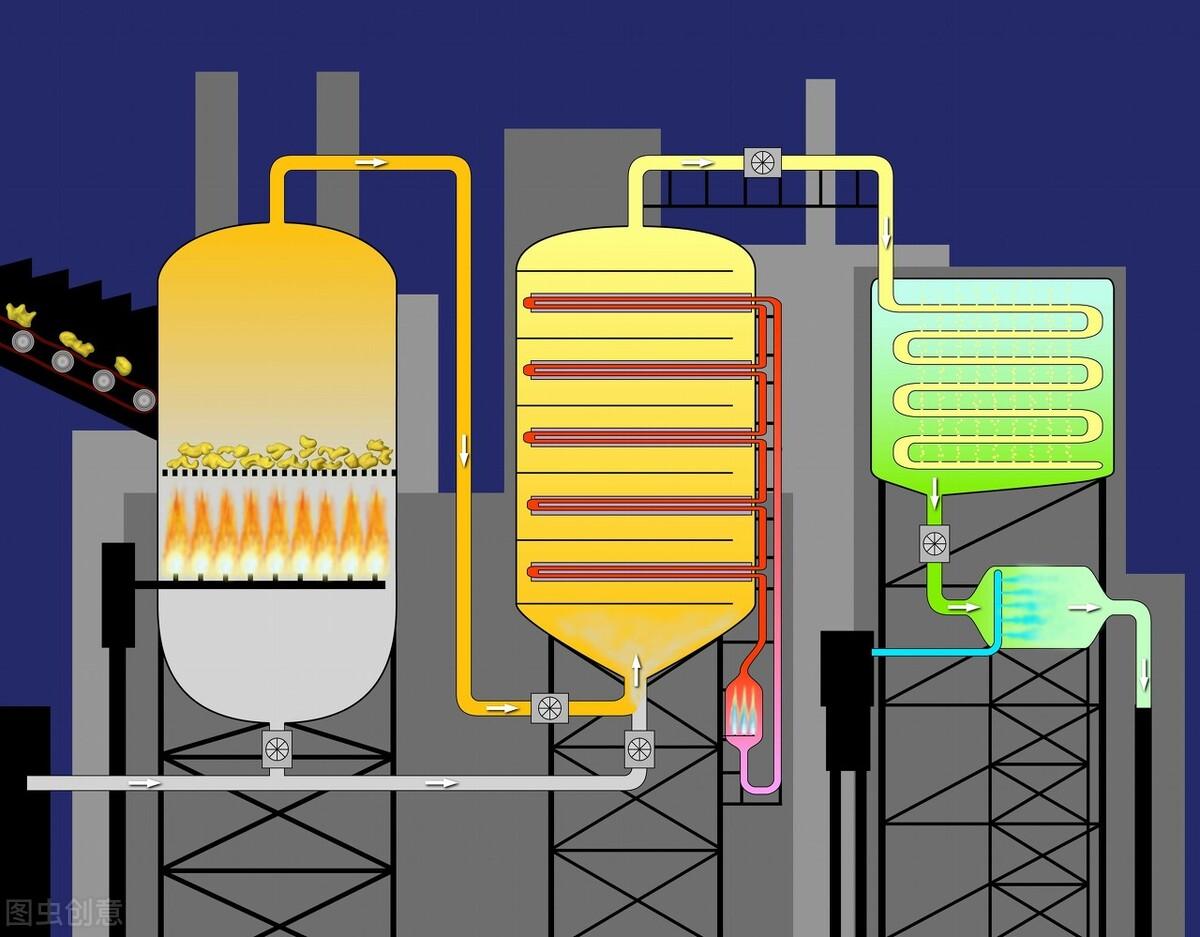
接触法制H2SO4是高中同学第一次对物质的工业制法的系统学习。由于化工生产涉及的化学原理较复杂,设备较多,使不少同学在学习中常感到摸不到头绪,抓不住要点。因此,本文拟以H2SO4的工业制法的分析为例,向同学们介绍学习工业生产知识的一般方法,以帮助大家学习这部分知识。
总的来说,按教学大纲的要求,化工生产知识只要求掌握反应原理及简单生产过程、典型设备、了解有关环境保护的初步知识,以便把化学反应原理与生产知识相结合,学习中不要求涉及生产的技术细节问题。
具体地讲,对于接触法制硫酸的学习,应抓住“六个三,一处理”。它们是:
1、三原料
①黄铁矿(FeS2),
②空气(O2),
③98.3%的浓H2SO4。
2、三阶段
①SO2的制取和净化,
②SO2氧化成SO3,
③SO3的吸收和H2SO4的生成。
3、三方程 对应于上述三阶段,依次有以下三个化学方程式:
①4FeS2+11O2(=高温)
2Fe2O3+8SO2
②2SO2+O2=
(V2O5 400℃-500℃)2SO3
③SO3+H2O=H2SO4
4、三设备 三阶段各自的主要设备为
① 沸腾炉,
② 接触室,
③ 吸收塔。
5、三净化 从沸腾炉里出来的炉气,砷、硒的化合物及矿尘,若直接进入接触室会导致催化剂中毒,还会造成设备的堵塞和腐蚀,因此必须经过下列三种净化装置处理:
除尘器,除去矿尘;
洗涤塔,洗掉砷、硒化合物;
干燥塔,用浓H2SO4吸收水蒸气。
6、三原理
① 热交换原理,
② 逆流原理,
③ 连续生产原理。
“一处理”即吸收搭导出的尾气中含有少量的SO2,若排入大气中会造成环境的污染,故工业上常用氨水作吸收剂回收尾气中的SO2,即氨吸收法,其反应原理为:
SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=
2NH4HSO3
总之,对于化工厂生产知识的学习,一定要抓住知识主干,避免在枝节问题上纠缠。